▎万海细胞集团-mRNA技术研发
基因编辑技术自问世以来,已有近 30 年的历史了。特别是 2012 年以来,随着 CRISPR技术的横空出世,基因编辑技术日渐趋于成熟。然而遗憾的是,相对于基因编辑工具本身的快速进化,其递送技术的发展极其缓慢和困难。
就比如,太空探索技术已经发展得很好了,但是火箭技术却没跟上来。由于递送技术的滞后发展,体内基因编辑治疗的临床应用困难重重,整个领域都在期待递送技术的突破。
mRNA技术在新冠疫苗的应用
疫情推动了mRNA疫苗和技术的研发与应用
mRNA技术在新冠疫苗领域一战成名,大规模的mRNA疫苗接种也充分验证了其较高的保护力和安全性,而且展示了将mRNA技术从研发推动到监管批准的道路。这一领域的创新产品开发也将成为新的方向,另外,“十四五”医药工业发展规划出台,指出要紧跟基因技术发展趋势,鼓励提升mRNA及其供应链能力。
mRNA技术作为一种极具潜力的通用技术平台,不仅可以应用于疫苗开发,还可以用于传染病的预防、肿瘤治疗、蛋白替代(罕见病疗法)、CAR-T、基因编辑等,正是因其巨大的潜力,万海细胞早在几年前就建立了多个mRNA技术项目,并在多个技术路线不断深耕。
什么是mRNA和mRNA疫苗?
RNA分子有三大类,信使RNA(mrna)、核糖体 RNA(rrna)、转运RNA(trna)。信使RNA是由DNA的一条链作为模板转录而来的、携带遗传信息的能指导蛋白质合成的一类单链核糖核酸。
mRNA疫苗作为一种通过体外转录构建的核酸疫苗,可将病毒无害的小片段呈现给免疫细胞“学习”并“演练”如何识别和攻击病毒,在下次“真枪实战”时可快速产生特异性免疫反应,从而防止病毒在人体复制和传播。
mRNA通过特定的递送系统进入人体细胞后,利用人体自身细胞翻译mRNA为蛋白质,蛋白质表达成为病毒所具有的某种抗原蛋白被抗原呈递细胞(APC)识别为外来抗原,驱动树突状细胞(DC)成熟,进而激活B细胞和T细胞产生强烈的免疫应答,引起体液和细胞双重免疫反应。
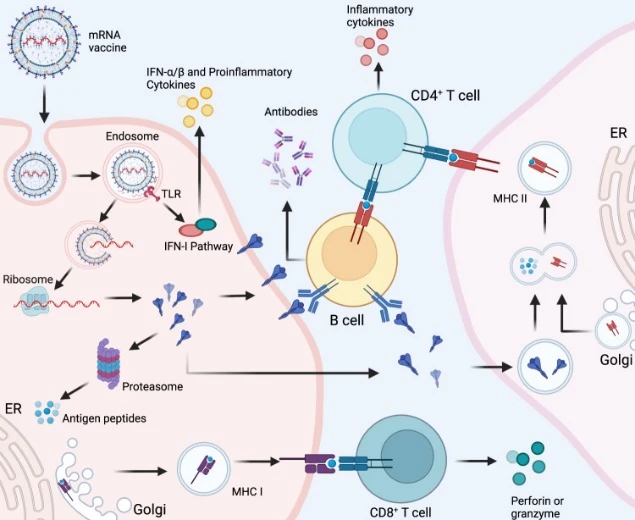
mRNA疫苗的作用机理
mRNA的设计和合成原理
mRNA疫苗的主要部分之一是人工合成的mRNA分子,它们指导细胞生成激发免疫反应的抗原。mRNA的结构可以分为5个部分,从5’端开始,分别是5’端帽,5’非转录区(UTR),编码抗原的开放阅读框,3’UTR和多腺嘌呤尾。每个部分对于mRNA疫苗的正常工作都至关重要。
5’端帽的作用之一是防止mRNA被细胞中识别病毒RNA的传感器发现,从而预防不必要的免疫反应。它还保护mRNA不受到核酸外切酶的降解。
3’多腺嘌呤尾的长度间接调节mRNA的转译和半衰期。它与5’端帽,以及与多腺嘌呤尾结合蛋白和转译启动蛋白一起,募集核糖体并且启动转译过程。
5’和3’UTR调节mRNA的转译、半衰期和细胞内定位。对UTR的工程化设计可以改变mRNA的细胞定位,或者降低mRNA的降解。
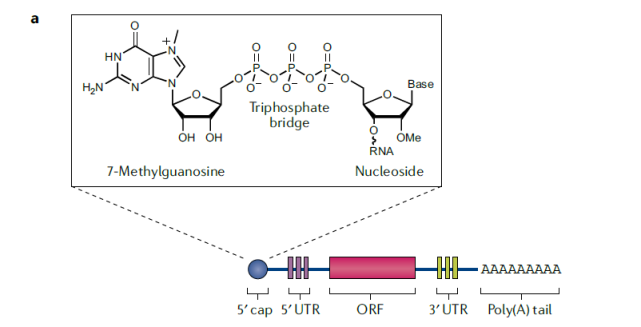
mRNA结构的5个部分。(参考资料1)
编码抗原的开放阅读框是最重要的一部分。这一部分的改良包括对mRNA密码子的优化,将不常用的密码子转换为编码同一氨基酸的常用密码子可以提高转译水平。例如,CureVac公司的新冠疫苗CVnCoV就使用了密码子优化。
提高转译的另一个改良措施是引入修饰过的核苷,例如假尿嘧啶,N1-甲基假尿嘧啶等核苷。由于自然mRNA都包含修饰过的核苷,因此免疫系统会将未修饰过的单链RNA识别为病毒感染的标志。人体细胞中的Toll样受体(TLR3、TLR7、TLR8)以及RIG-I受体称为模式识别受体(pattern recognition receptors),它们能够触发1型干扰素的产生,从而阻断mRNA的转译。
使用修饰过的核苷能够防止模式识别受体的识别,从而让mRNA生成足够水平的蛋白抗原,激发免疫反应。Moderna和辉瑞/BioNTech的mRNA新冠疫苗都使用了修饰过的核苷。
CureVac防止mRNA被模式识别受体发现的策略是通过序列工程化和密码子优化来消除疫苗mRNA中的尿嘧啶,同时提高GC水平。
未来展望
mRNA疫苗技术及其在COVID-19上的成功为探索其对各种疾病的用途打开了大门,为科学家提供了一个针对任何病毒的基本模板。他们可以简单地插入特定病毒蛋白的代码,并刺激人体的免疫系统对抗它。一些针对HIV,寨卡病毒和狂犬病等疾病的mRNA疫苗已经处于人体试验阶段。其他潜在的疫苗用途包括:疟疾囊肿性纤维化、结核、乙型肝炎、治疗某些类型的癌症等。

将mRNA扩展到疫苗以外的应用领域,需要解决提高mRNA表达的蛋白水平,以及mRNA疗法因为多次给药产生的潜在毒副作用问题。我们期待随着mRNA技术研究的发展、投递介质和技术的改进以及更多临床试验的研究进展,它能够在疫苗之外,为更多疾病患者造福。
END
部分图文来自网络,侵删









