全球新冠疫情任燃严峻
近日,解放军总医院第五医学中心感染病诊疗与研究中心主任、国家感染性疾病临床医学研究中心主任王福生院士团队公布了使用人脐带间充质干细胞(UC-MSCs)治疗COVID-19重症患者随访1年的结果,文章发表于《柳叶刀》子刊——EBioMedicine。此前国内外尚无关于UC-MSCs治疗COVID-19患者长期随访数据的报道,结果显示:UC-MSCs给药对COVID-19患者肺部病变和症状的恢复具有长期益处。

▲ 图源:EbioMedicine
研究对此前参加 II 期临床试验的100名患者进行了前瞻性随访,每隔3个月随访一次,为期1年,以此评估UC-MSCs治疗的长期安全性和有效性。主要终点是使用高分辨率CT检测到的全肺病变体积百分比的改变,记录和分析其他影像学报告结果、6分钟步行距离(6-MWD)、肺功能、血浆生物标志物和不良事件。
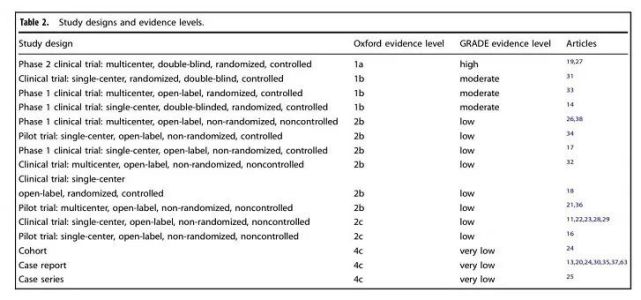
值得一提的是,此项研究的数据被牛津大学循证医学证据(Oxford evidence level)分级列为最高的1a,GRADE证据质量分级(GRADE evidence level)列为高级证据,并被今年11月发表在Nature子刊Regenerative Medicine的一篇review所引用。
UC-MSC治疗新冠重症患者长期随访数据积极
自2019年新冠疫情爆发以来,全球范围内确诊病例还处于不断攀升的阶段。截至2022年2月26日,全球已有超过4.33亿病例确诊。随着疫苗的大范围接种和中和抗体的使用,死亡率和住院率得到极大下降。但是有传播就会有突变,地球村的时代,任何一个国家出现特别强的突变株都会最终占领全世界,来自英国阿尔法,来自印度的德尔塔,到现在在南非发现的奥密克戎。
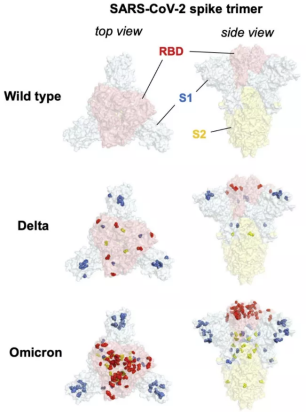
▲ 新冠刺突蛋白的立体图,从上到下依次是原始毒株,德尔塔变体,奥密克戎变体
可以看出相对于原始毒株,德尔塔有9个突变分布在刺突上,而奥密克戎有密密麻麻34个,而且其中很多就是在刺突蛋白和抗体结合的表面上(红色点)。所以疫苗的保护作用下降和中和抗体药物失效也就在所难免。
新冠病毒可严重损害肺部,从轻度呼吸系统疾病到重症急性呼吸综合征、甚至死亡。目前对住院患者的治疗方法以支持性疗法和抗病毒疗法、抗菌疗法为主,对于满足指征的患者还可考虑应用免疫疗法。
近年来,间充质干细胞被广泛应用到了肺部疾病的治疗研究中。多项临床前研究已经证实间充质干细胞具有治疗急性肺损伤(ALI)、急性呼吸窘迫综合征(ARDS)的潜能。研究发现,人脐带间充质干细胞对H5N1感染的人肺泡上皮细胞的肺泡液清除率和蛋白质通透性具有明显的修复作用,此外,间充质干细胞外泌体可以通过RNA转移减少病毒复制,降低肺泡上皮细胞的死亡,缓解流感病毒导致的急性呼吸窘迫综合征症状。
2020年起国内外也展开了多个使用各类MSCs作为新冠患者治疗方法的临床实验。结果显示MSCs不仅显著降低了患者肺损伤,减少了恢复时间,而且在早期耐受性良好的情况下,提高了患者的生存率。其中,UC-MSCs作为MSCs中来源丰富、制备方便的选择,也吸引了诸多关注。
此前,王院士团队开展的UC- MSC治疗新冠重症患者的双盲、随机、安慰剂对照II期临床试验,共纳入100名患者。除了接受标准的治疗以外,患者分为接受UC-MSC治疗组(n = 65)和安慰剂(n = 35)治疗组。随访28天后,在第3、6、9、12个月,对所有患者进行后续随访,以评估治疗的安全性和有效性。
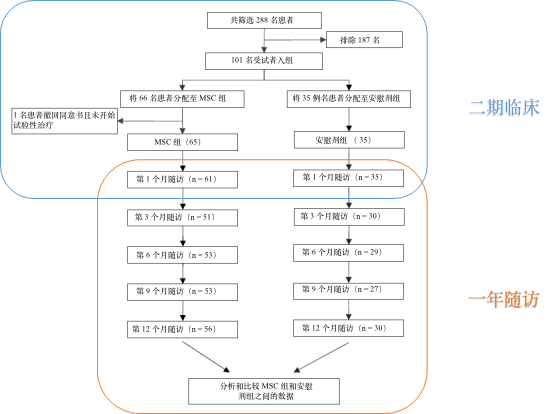
▲ 临床试验流程
研究结果显示,UC-MSCs给药3个月后对COVID-19重症患者的全肺病变仍有改善作用。与安慰剂组相比,在各随访时间点上,UC-MSCs给药组的肺实性病变获得更大缓解,其中第9个月差异最显著。在第12个月,有17.9% UC-MSCs组患者(10/56)CT图像正常,而安慰剂组中全不正常。此外,随访12个月期间,未观察到UC-MSCs输注相关的不良事件发生。UC-MSCs组和安慰剂组患者中不良事件发生率和评估的肿瘤标志物相似。
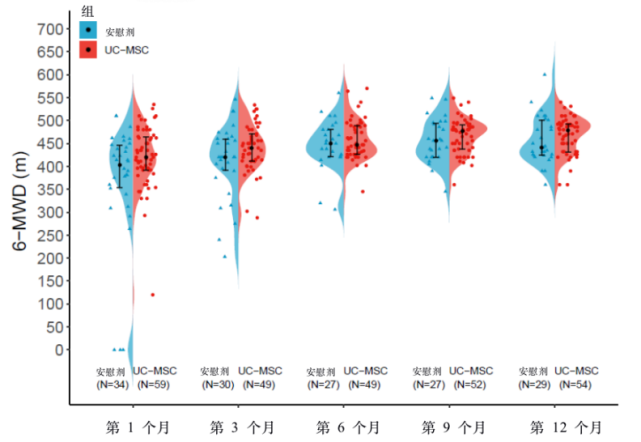
▲ 长期随访中UC-MSCs影响COVID-19重症患者6MWD的比较
6-MWD是一个反映复杂生理学综合储备能力的重要参数,包括肺和心血管系统以及神经肌肉循环。与安慰剂组相比,UC-MSCs组的患者在各随访节点上6-MWD数值均有增加。这可能由于UC-MSC给药后对肺部损伤的改善,肺部储备能力的恢复。
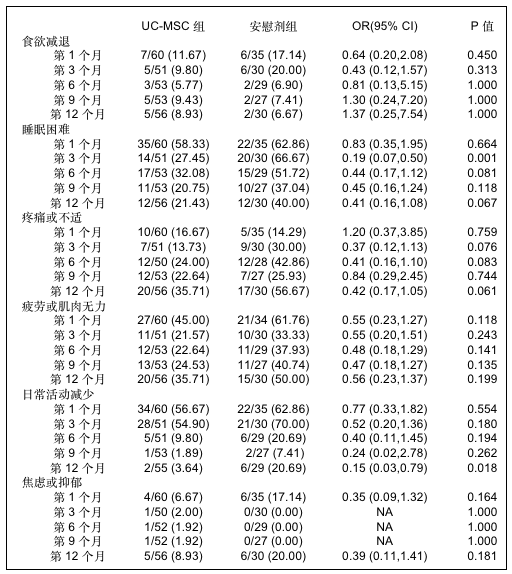
▲ 随访期间UC-MSCs组和安慰剂组症状和生命健康相关质量的比较
COVID-19患者发病6个月后仍会存在诸如疲劳、肌肉无力和睡眠困难等常见的症状。部分患者在出院12个月后仍可观察到肺部生理异常。与以前的研究一致,68.6%入组患者在为期12个月的随访中仍至少存在一种症状。与安慰剂组相比,接受UC-MSCs治疗的患者症状更轻和生活质量更好,睡眠困难、日常活动和NRS评分均得到显著改善。MSCs作用的潜在机制还没有完全阐明,推测可能是由于MSC分泌的肝细胞生长因子、血管内皮生长因子和角质细胞生长因子,促进了肺泡II型上皮细胞的再生,改善了肺部损伤。此外,MSCs可被相应的趋化因子吸引至炎症部位,然后通过直接接触和旁分泌作用调节各种免疫细胞的功能,发挥长期效应。
随着时间的推移患者体内中和抗体逐渐下降,在第12个月两组患者的中和抗体IR仍呈阳性,中位值抑制率相近(61.6%:67.6%),这表明UC-MSCs治疗未影响患者中和抗体的产生和维持。以上结果显示,UC-MSCs给药不仅取得了有益的短期疗效,还对COVID-19重症患者的肺部病变发挥了长期的治疗作用,同时具有良好的耐受性。
临床数据有效验证UC-MSCs
作为辅助疗法的可行性
新型冠状病毒肺炎(COVID-19)疫情发生后,国家紧急启动了“人干细胞用于治疗2019-nCoV感染肺炎的临床研究”、“CAStem细胞药物治疗重型新冠肺炎研究”和“应对新冠肺炎的间充质干细胞治疗研究”等应急科技攻关项目。
王福生院士带领团队第一时间对间充质干细胞治疗新冠肺炎临床研究展开应急攻关,其中干细胞治疗新冠肺炎1期临床研究结果2020年8月刊登在Nature子刊Signal Transduction and Targeted Therapy上,初步证实脐带间充质干细胞(UC-MSCs)对于普通型和重型新冠肺炎患者的安全性和临床益处。

▲ 图源:Nature

▲ 图源:Nature
UC-MSCs的2期研究纳入了2020年3月5日至2020年3月28日期间,在武汉市的两家医院接受治疗的COVID-19重症患者,大部分住院的COVID-19重症患者处于恢复期,部分处于进展期。与1期研究相比,本次研究招募的患者均为重症患者,病程较长,年龄较大。尤其是所有患者都有严重的肺损伤,在病程中需要氧气支持。经过筛选,最终共计100名COVID-19患者注射了UC-MSCs(n=65)或安慰剂(n=35)。根据方案,除了标准治疗外,治疗组在第0、3、6天接受静脉输注UC-MSCs,剂量为4X107个细胞。研究主要终点为基线至第28天,病变体积占全肺体积比例(%)的变化,旨在评估患者肺损伤的临床改善。
从基线到第28天,UC-MSC治疗组总病变体积占全肺体积比例(%)的变化为-19.40%,安慰剂组为-7.30%,两组间的差异为-13.31%。除此之外,实性病变部分消退的差异更为显著,为-15.45%。该研究结果提示了,UC-MSCs给药对新冠肺炎患者具有显著的治疗益处。在第28天的6分钟步行试验(6-MWT),UC-MSCs治疗组(中位数420.00米)的6分钟步行距离超过安慰剂组(中位数403.00米),但无统计学差异。MSC治疗组和安慰剂组的不良事件发生率相似(55.38%;60%)。未观察到与MSC相关血流动力或呼吸系统不良事件。随访期间无患者死亡。UC-MSC的安全性结果符合1期临床试验和其他MSC研究的结果。这些数据表明,UC-MSC治疗耐受性良好并且非常安全。
UC-MSC长期效果值得继续评估
综合临床1/2期的结果可以看出,UC-MSCs加速了COVID-19重症患者肺实性病变的消退,改善了肺的综合储备能力,并证实UC-MSCs具有良好的耐受性和安全性。此次的1年随访观察进一步确认,UC-MSCs输注为重症患者肺部病变带来了长期的症状缓解且耐受性良好。这表明UC-MSCs细胞治疗为COVID-19肺损伤重度患者提供了一种安全、且潜在有效的治疗选择。UC-MSCs治疗的长期效果值得在未来对伴有严重肺损伤的COVID-19康复患者的试验中继续进行评估。
随着我国首个《间充质干细胞治疗新型冠状病毒肺炎专家共识》发布,国内间充质干细胞治疗新冠肺炎的临床研究将会越来深入,我们也期待干细胞治疗新冠肺炎药物早日到来,疫情早日结束!
参考资料:
1. Shi L , X Yuan, Yao W Q , et al. Human Mesenchymal Stem Cells Treatment for Severe COVID-19: 1-Year Follow-Up Results of a Randomized, Double-Blind, Placebo-Controlled Trial[J]. Social Science Electronic Publishing.
2. Therapeutic implications of human umbilical cord mesenchymal stromal cells in attenuating influenza A/H5N1-associated acute lung injury[J]. Journal of Infectious Diseases, 2018.
3. Khatri M , Richardson L A , Meulia T . Mesenchymal stem cell-derived extracellular vesicles attenuate influenza virus-induced acute lung injury in a pig model[J]. Stem Cell Research & Therapy, 2018, 9(1):17.
4. Zheng G , Huang L , Tong H , et al. Treatment of acute respiratory distress syndrome with allogeneic adipose-derived mesenchymal stem cells: a randomized, placebo-controlled pilot study[J]. Respiratory Research, 2014, 15(1):39.
END









